医疗器械主文档是一种技术资料形式,此资料主要包括医疗器械原材料的技术资料:原材料组成成分描述、理化性能研究资料、生物学评价资料、毒理学风险分析资料等,具体视申报对象的具体情况而定。
主文档适用范围
申请对象
代理人
费用
责任主体
主文档登记对主文档所有者无GMP要求,但若医疗器械注册引用的主文档需要涉及GMP的合规,则主文档申请人应视情况满足相关要求以便主文档内容可以被医疗器械注册成功引用。
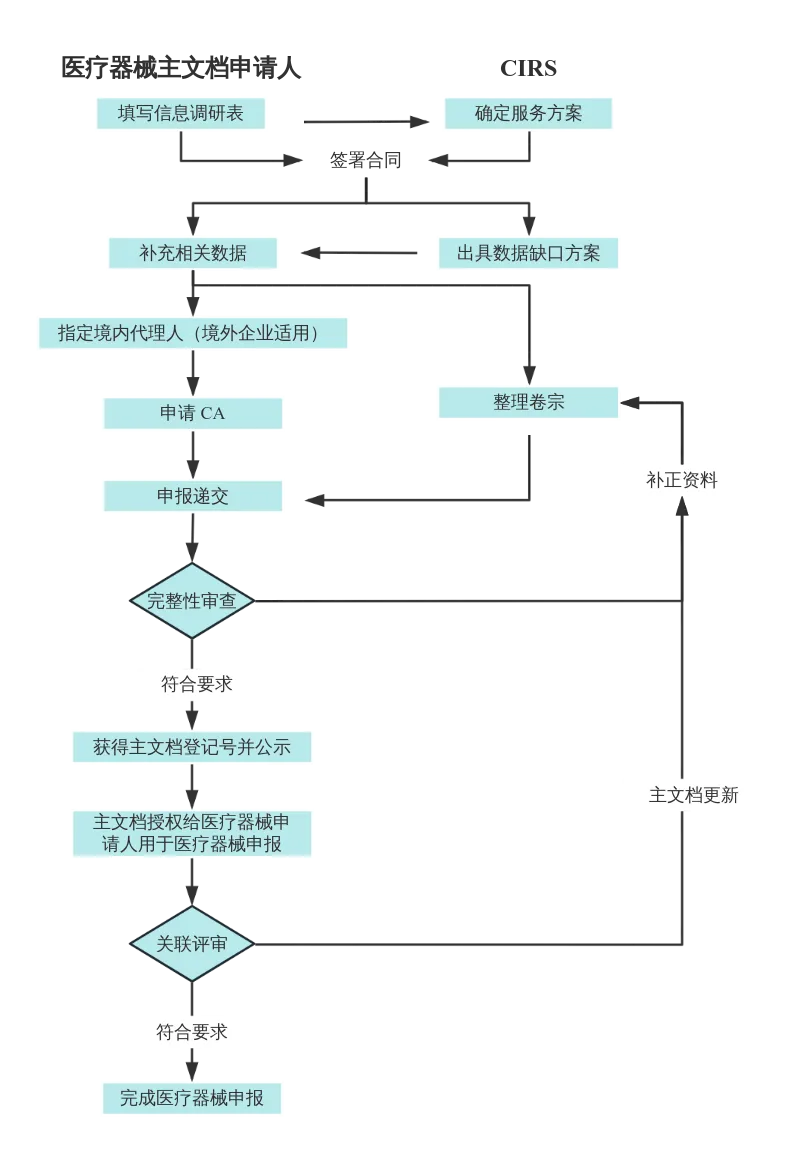
医疗器械主文档登记服务流程
医疗器械主文档登记资料
主文档所有者可以通过医疗器械监管机构对主文档进行更新,包括授权情况的变化、代理机构的变化以及主文档内容的任何变化。更新相关资料以变化对比表的形式提交。
主文档资料发生变更可能会对导致医疗器械与已批准的产品发生实质性差异,因此主文档持有人应尽可能地详细告知医疗器械制造商变化内容。

